
取消
清空記錄
歷史記錄
清空記錄
歷史記錄



具有更強免疫原性的mRNA疫苗你了解多少?(下)
本文文章來源于知乎《mRNA疫苗學(xué)習(xí)(下)》作者:卷毛哥的奇跡
此前AVT小編給小伙伴們分享了一下具有更強免疫原性的mRNA疫苗的相關(guān)知識,mRNA疫苗需要你了解的知識可不只有那些哦,本期我們接著聊一聊mRNA疫苗的那些事!
裸露的mRNA作為一種外源的核酸物質(zhì),進(jìn)入體內(nèi)后很容易免疫系統(tǒng)識別和被核酸酶降解,因此直接用裸露的mRNA作為疫苗其藥理作用會大打折扣。為了提高mRNA疫苗的免疫效率,通常需要特殊遞送系統(tǒng)的輔助。
mRNA疫苗的給藥方式
mRNA疫苗的給藥方式非常重要,會決定mRNA疫苗在體內(nèi)的代謝,及目的抗原蛋白翻譯的效率。例如,如果直接靜脈注射未經(jīng)任何處理的裸露mRNA,就會被血液中的核酸酶迅速降解。
mRNA疫苗的給藥也分為系統(tǒng)給藥或者局部給藥,根據(jù)抗原蛋白需要表達(dá)的位置來決定。如果是預(yù)防性疫苗,為了引起較強的免疫反應(yīng),通常用皮下和肌肉注射的局部給藥。如果是治療性mRNA疫苗通常通過腹腔或者靜脈注射系統(tǒng)給藥(這也包括下文述及的經(jīng)DC細(xì)胞給藥)。

mRNA疫苗局部和系統(tǒng)給藥
經(jīng)DC細(xì)胞給藥
mRNA疫苗另外一種非常重要的給藥方式是通過DC細(xì)胞的轉(zhuǎn)染進(jìn)行給藥,分為體內(nèi)和體外兩種DC細(xì)胞介導(dǎo)的方式。DC細(xì)胞是人體重要的抗原遞呈細(xì)胞,其攝取抗原后可以誘導(dǎo)隨后的免疫反應(yīng)。在體外分離得到人體未成熟的DC細(xì)胞后,可以通過電穿孔技術(shù)轉(zhuǎn)染mRNA,再把轉(zhuǎn)染后的DC細(xì)胞過繼入人體,產(chǎn)生被動免疫。但是通過體外DC轉(zhuǎn)染的方式遞送mRNA疫苗對技術(shù)的要求非常高,需要較長的體外培養(yǎng)時間,而且首先需要獲取人體的DC細(xì)胞,在普通條件下難以實現(xiàn)。另外一個通過DC細(xì)胞給藥的方式是淋巴內(nèi)給藥,mRNA被直接注射到淋巴內(nèi),這樣mRNA就可以被淋巴內(nèi)固有DC細(xì)胞獲取,但是這種給藥方式通常需要手術(shù)輔助,導(dǎo)致給藥非常復(fù)雜且?guī)Я舜罅康娘L(fēng)險。
因此,經(jīng)DC細(xì)胞給藥的方式不適合預(yù)防性mRNA疫苗的給藥,只有在一些治療性mRNA疫苗的給藥可能會被使用。
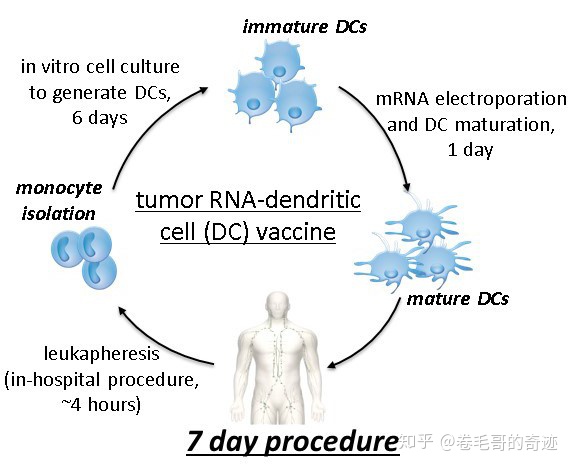
mRNA經(jīng)體外DC系統(tǒng)給藥(癌癥疫苗)
mRNA的制劑系統(tǒng)
為了保證mRNA疫苗的代謝穩(wěn)定性和免疫活性,除了慎重評估給藥方式外,還需要對mRNA疫苗的劑型進(jìn)行特殊設(shè)計。mRNA進(jìn)入體內(nèi)后,首先面臨周圍組中(如:血液)核酸酶的降解,另外還需要穿過具有磷脂雙分子層細(xì)胞膜。因此,mRNA疫苗的制劑系統(tǒng)需要保護(hù)mRNA不被核酸酶降解,而且還需要促進(jìn)mRNA被細(xì)胞(APC、B細(xì)胞和T細(xì)胞等免疫細(xì)胞)攝取。
已經(jīng)有大量的mRNA制劑系統(tǒng)見諸報道,其中的很多已經(jīng)進(jìn)入臨床試驗階段。這些制劑技術(shù)都是通過形成特殊的mRNA載體,來實現(xiàn)mRNA疫苗的遞送,這些載體技術(shù)包括:魚精蛋白載體技術(shù)、納米顆粒脂質(zhì)體載體技術(shù)、多聚體載體技術(shù)
·魚精蛋白載體:
魚精蛋白是一種天然的陽離子蛋白,可以把帶負(fù)電的mRNA分子絡(luò)合成納米級別的核酸顆粒,從而保護(hù)mRNA不被血清中的RNA酶降解;但是由于魚精蛋白和mRNA的結(jié)合太緊密,因此采用這種制劑的mRNA疫苗的蛋白表達(dá)效率會受限,另外抗原的表達(dá)很大程度上也受到魚精蛋白和mRNA比例的影響。德國CureVac公司開發(fā)的 RNActive平臺成功解決了這個問題,通過RNActive平臺得到的魚精蛋白-mRNA復(fù)合物其中,魚精蛋白作為TLR7/8拮抗劑可以誘發(fā)Th1細(xì)胞反應(yīng),mRNA可以表達(dá)目的蛋白誘導(dǎo)特異的免疫反應(yīng)。
另外,魚精蛋白-mRNA組成的納米級顆粒還可以進(jìn)一步制備成脂質(zhì)體,這種脂質(zhì)體-魚精蛋白-mRNA的制劑形式,兼有脂質(zhì)體載體和魚精蛋白載體的優(yōu)勢。
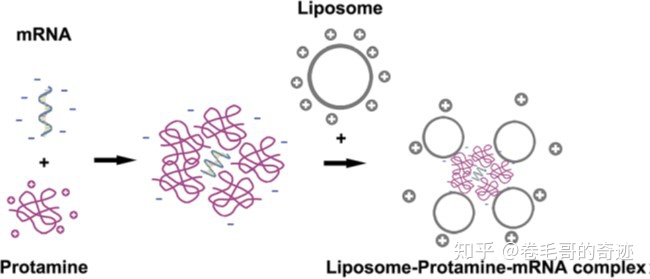
魚精蛋白制劑及魚精蛋白-脂質(zhì)體制劑示意圖
·納米顆粒脂質(zhì)體(Lipid nanoparticles,LNPs):
LNP由四部分組成:陽離子脂質(zhì)體、脂質(zhì)體相連的聚乙二醇(增加半衰期),膽固醇(起到穩(wěn)定制劑結(jié)構(gòu)的作用)和磷脂(支持形成磷脂雙分子層)。脂質(zhì)體實際上是一種人工膜,可以將藥物包封于類脂質(zhì)雙分子層內(nèi)而形成微型泡囊體。
LNP遞送RNA的原理目前還不完全清楚,但是通常認(rèn)為,LNP通過非共價親和力和細(xì)胞膜結(jié)合并通過內(nèi)吞作用被攝取,進(jìn)入細(xì)胞后mRNA逃離內(nèi)吞小泡,被釋放到細(xì)胞質(zhì)中表達(dá)靶蛋白。有意思的是,LNP還可以通過相反的胞吐作用被排出細(xì)胞外,這也是通過LNP進(jìn)行mRNA給藥需要注意的點。mRNA–LNP復(fù)合物的那器官為肝臟,進(jìn)入體內(nèi)后制劑和載脂蛋白E結(jié)合,隨后通過受體介導(dǎo)的內(nèi)吞作用,被肝臟細(xì)胞攝取;
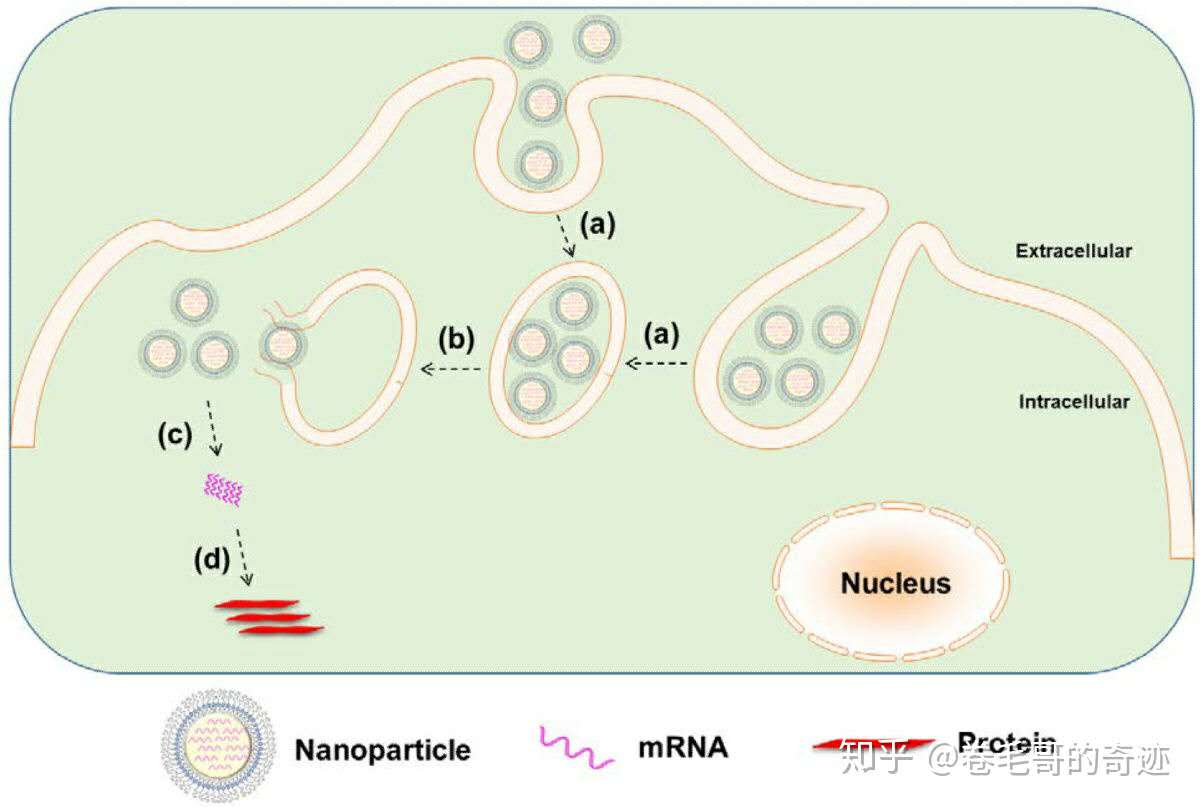
細(xì)胞內(nèi)部脂質(zhì)體mRNA疫苗的蛋白表
·多聚體載體
多聚體載體技術(shù)在臨床上的應(yīng)用并沒有脂質(zhì)體類載體廣,但是作為核酸藥物的載體也表現(xiàn)了優(yōu)異特性。多聚體載體通常為陽離子聚合物,陽離子聚合物可以通過靜電作用跟帶負(fù)電的mRNA形成多聚體,最終形成polyplexes或者micelleplexes;micelleplex由陽離子兩親性的共聚物生成,可以聚合形成膠束,通常表現(xiàn)出比polyplex更優(yōu)異的穩(wěn)定性,因為后者并不會形成膠束結(jié)構(gòu)。在進(jìn)行多聚體載體設(shè)計的時候需要額外考慮多聚體載體的分子量以及帶電荷量,過大的載體分子和過多的載電量通常導(dǎo)致載體和mRNA分子結(jié)合太過穩(wěn)定,而導(dǎo)致mRNA的表達(dá)效率過低。
在眾多多聚物載體材料中,聚乙烯亞胺(PEI)是最常用的陽離子聚合物,已經(jīng)被廣用作mRNA疫苗的載體;大分子量的聚乙烯亞胺更適合作為自我復(fù)制性mRNA疫苗的載體,因為自我復(fù)制性mRNA的分子量較且結(jié)構(gòu)復(fù)雜,但是高分子量的聚乙烯亞胺同時會帶來較高的毒性副作用,而且高分子量的聚乙烯亞胺對mRNA的結(jié)合非常穩(wěn)定以至于無法順利的在細(xì)胞質(zhì)中釋放mRNA;但是小分子量的PEI的轉(zhuǎn)染能力有限;除了PEI外還有其他的分子被用來作為載體,例如:甲基丙烯酸二甲氨基乙酯(PDMAEMA)。
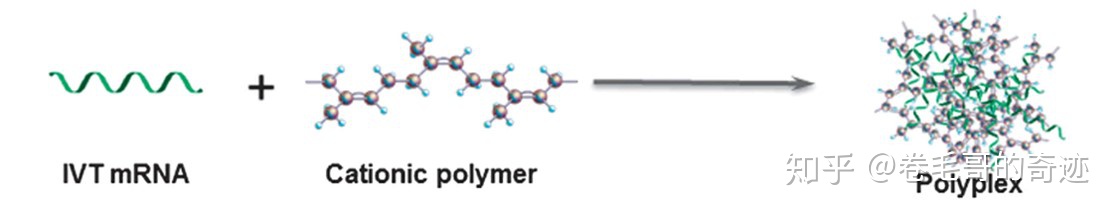
多聚體生成路線
·脂質(zhì)體-多聚體納米顆粒載體
脂質(zhì)體-多聚體納米顆粒載體,顧名思義為脂質(zhì)體載體技術(shù)和多聚體納米顆粒技術(shù)的聯(lián)合使用。在結(jié)構(gòu)上,多聚體材料是載體的內(nèi)核,而脂質(zhì)或脂質(zhì)-PEG包裹著內(nèi)核形成脂質(zhì)體。
mRNA可以通過兩種形式跟脂質(zhì)體-多聚體納米顆粒載體結(jié)合,第一種方式是結(jié)合在帶正電荷的多聚體核心中,第二種方式是吸附在帶正電荷的多聚體核心外側(cè)。采用第二種方式結(jié)合的mRNA,可能更容易被釋放。
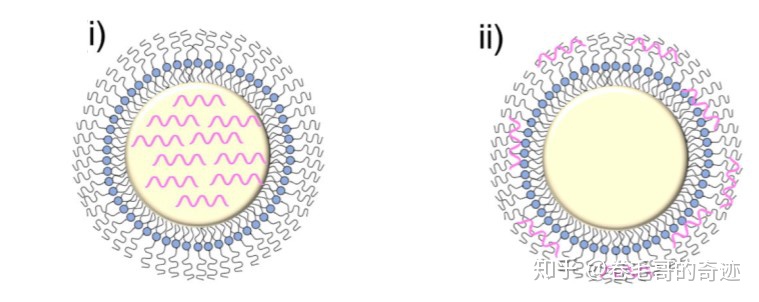
左:第一種方式;右:第二種方式
參考文獻(xiàn)
1.Biomaterials for mRNA delivery[J]. Biomater. Sci. 2015, 3(12):10.1039.C5BM00198F.
2.Men K , Zhang R , Zhang X , et al. Delivery of modified mRNA encoding vesicular stomatitis virus matrix protein for colon cancer gene therapy[J]. Rsc Advances, 2018, 8(22):12104-12115.
3.Sahin U , Karikó, Katalin, Türeci, ?zlem. mRNA-based therapeutics — developing a new class of drugs[J]. Nature Reviews Drug Discovery, 2014, 13(10):759-780.
4.Kowalski P S , Rudra A , Miao L , et al. Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery[J]. Molecular Therapy, 2019.
5.Lu T , Xun S . Recent advances in mRNA vaccine delivery[J]. Nano Research, 2018.
6.Pardi N , Hogan M J , Porter F W , et al. mRNA vaccines — a new era in vaccinology[J]. Nature Reviews Drug Discovery, 2018.
7.Youn H , Chung J K . Modified mRNA as an alternative to plasmid DNA (pDNA) for transcript replacement and vaccination therapy[J]. Expert Opinion on Biological Therapy, 2015:1-12.
8.Schlake T , Thess A , Fotin-Mleczek M , et al. Developing mRNA-vaccine technologies[J]. RNA biology, 2012, 9(11):1319-1330.




 瀏覽器自帶分享功能也很好用哦~
瀏覽器自帶分享功能也很好用哦~




